Ema avvia la "rolling review" sulla pillola anti-Covid di Merck
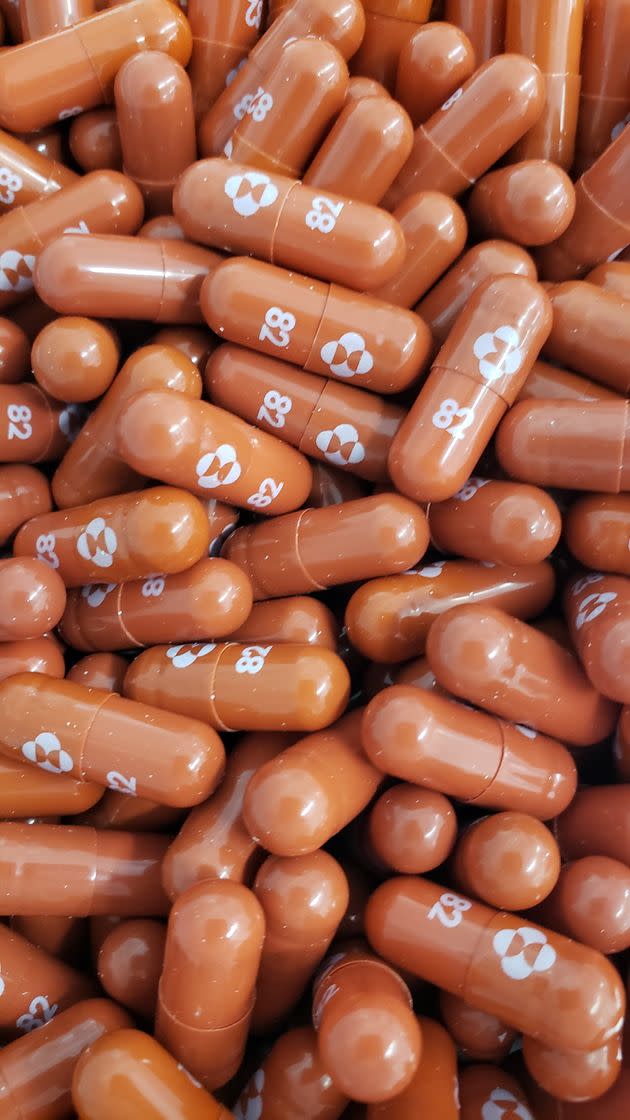
Si chiama molnupiravir e molti la considerano la probabile svolta nella lotta contro il SarsCov2. È la “pillola della Merck”, la casa farmaceutica americana che ha sviluppato un farmaco che promette bene nella battaglia contro il Covid. L’Authority europea per il farmaco (Ema) ha annunciato di aver avviato la “rolling review” sul farmaco anti-Covid sperimentale per adulti.
La rolling review è uno strumento regolatorio di cui l’Ema si serve per accelerare la valutazione di un medicinale o vaccino promettenti durante un’emergenza sanitaria pubblica. Se autorizzato, il molnupiravir potrebbe essere il primo farmaco antivirale orale per il trattamento della malattia innescata da Sars-CoV-2. I tempi per la sua valutazione sono solitamente stimati in 2-3 mesi.
Merck, che sviluppa molnupiravir con Ridgeback Biotherapeutics, ha presentato l′11 ottobre scorso la richiesta di autorizzazione per l’uso d’emergenza negli Usa. Nei test clinici, fra i pazienti ad alto rischio che hanno preso due pillole al giorno per 5 giorni, il 50% rispetto al placebo, ha evitato il ricovero e nessuno è morto.
È scattata la corsa al farmaco. Gli Usa, primi al traguardo, a giugno hanno firmato un contratto da 1,2 milioni di dollari per 1,7 milioni di cicli: 700 dollari a trattamento (10 pillole). Altri accordi di fornitura sono stati siglati con Regno Unito, Malaysia e Singapore. Anche l’Europa si era detta interessata a negoziare un accordo di fornitura, ma non prima dell’avvio del processo regolatorio.
Questo articolo è originariamente apparso su L'HuffPost ed è stato aggiornato.

 Yahoo Finanza
Yahoo Finanza 